Той няма геометрични изомери. Стереоизомерия. Какво е изомерия
Пространствените изомери (стереоизомери) имат еднакъв качествен и количествен състав и един и същ ред на свързване на атомите (химична структура), но различно пространствено разположение на атомите в молекулата.
Има два вида пространствена изомерия: оптиченИ геометричен.
Оптична изомерия
При оптичната изомерия различните фрагменти от молекули са разположени различно спрямо определен атом, т.е. имат различни конфигурацияНапример:
Такива молекули не са идентични, те се отнасят една към друга като обект и неговия огледален образ и се наричат енантиомери.
Енантиомерите имат свойствата на хиралност. Най-простият случай на хиралност се дължи на присъствието в молекулата център на хиралност(хирален център), който може да бъде атом, съдържащ четири различни заместителя. Такъв атом няма елементи на симетрия. Поради тази причина се нарича още асиметричен.
За да се установи дали една молекула е хирална, е необходимо да се изгради неин модел, модел на нейния огледален образ (фиг. 3.1 , А)и разберете дали са комбинирани в пространството. Ако не са съвместими, молекулата е хирална (фиг. 3.1, b), ако са съвместими, тя е ахирална.

Ориз. 3.1.

Всички химични свойства на енантиомерите са идентични. Техните физически свойства също са еднакви, с изключение на оптичната активност: едната форма завърта равнината на поляризация на светлината наляво, другата - на същия ъгъл надясно.
Смес от равни количества оптични антиподи се държи като отделно химично съединение, лишено от оптична активност и много различно по физични свойства от всеки от антиподите. Това вещество се нарича рацемична смес, или рацемат.
При всички химични трансформации, при които се образуват нови асиметрични въглеродни атоми, винаги се получават рацемати. Има специални техники за разделяне на рацемати на оптически активни антиподи.
Ако в една молекула има няколко асиметрични атома, е възможна ситуация, при която пространствените изомери няма да бъдат оптични антиподи. Например:

Наричат се пространствени изомери, които не са енантиомери един спрямо друг диастереомери.
Специален случай на диастереомери - геометричен (cis-trais-)изомери.
Геометрична изомерия
Геометрична (цис-транс) изомерияе характерно за съединения, съдържащи двойни връзки (C=C, C=N и др.), както и за неароматни циклични съединения и се дължи на невъзможността за свободно въртене на атомите около двойна връзка или в цикъл. Заместителите в геометричните изомери могат да бъдат разположени от едната страна на равнината на двойната връзка или пръстена - ^wc-позиция, или от противоположните страни - tirsh/c-позиция (фиг. 3.2).

Ориз. 3.2. Дис-изомер (а) итранс-изомерб)
Геометричните изомери обикновено се различават значително по физични свойства (точки на кипене и топене, разтворимост, диполни моменти, термодинамична стабилност и др.)
- Терминът "хиралност" означава, че два обекта са в същото отношение един към друг като лявата и дясната ръка (от гръцки стол - ръка), т.е. са огледални образи, които не съвпадат, когато се опитате да ги комбинирате в пространството.
Геометричните изомери възникват, ако свободното въртене на атомите в молекулата е ограничено поради наличието на двойна връзка. Пример за такава двойка изомери са малеиновата (12.23) и фумаровата (12.24) киселини (съответно цис- и транс-).
Геометричните изомери са много сходни по химическа структура, но не са огледални образи един на друг и не въртят равнината на поляризация на светлината. По правило цис- и транс-изомерите се различават значително по физични свойства. Например малеиновата киселина (12.23) се топи при 130 °C, нейната стойност на pKa е 1,9, тя е много разтворима в студена вода (79 g на 100 ml); константите на неговия геометричен изомер - фумарова киселина (12.24) са съответно 287 °C, 3.0 и 0.7 g на 100 ml. Не е изненадващо, че геометричните изомери имат различни биологични свойства и затова е много важно при изучаването на химичната формула на ново съединение да се вземат предвид всички възможности за съществуването на този тип изомерия.
Цис и транс изомерите могат лесно да се разделят чрез кристализация или хроматография. Няма общ метод за превръщане на един изомер в друг, но нагряването обикновено произвежда най-стабилния изомер, докато излагането на светлина произвежда по-малко стабилен. Човешкото зрение зависи от превръщането на 11-цис изомера на ретината в 11-транс форма под въздействието на светлина. Веднага щом вълнуващия лъч светлина изчезне,
Този каротеноиден пигмент отново преминава в цис форма, като по този начин прекъсва импулса, отиващ към мозъка.Цис и транс изомери също съществуват на плоския циклопентанов пръстен, който е като голяма двойна връзка. Въпреки че циклохексановият пръстен изобщо не е плосък, той все пак е достатъчно плосък, за да образува цис и транс изомери. По този начин съществуват и са налични както цис (12.25), така и транс (12.26) форми на диаминоциклохексан. Една и съща молекула може да образува както геометрични, така и оптични изомери. Например, транс изомерът (12.26) може да бъде разделен на (S,S) (12.27) и (R.R) (12.28) хирални изомери. Въпреки това, цис изомерът не може да бъде разделен на хирални форми, тъй като има равнина на симетрия. Бензеновият пръстен няма геометрични изомери, тъй като всеки въглероден атом на пръстена има само един заместител.
Цис-транс-TpaHC-(S S) TpaHC-(R.R) (12.25) (12.26) (12.27) (12.28) |
Стереоизомери на 1,2-диаминоцинлогензан
Понякога може да бъде трудно да се изберат два от четирите заместителя на двойна връзка, за да се определи цис или транс конфигурацията. Правилото за последователност диктува да се избират заместители с най-тежките атоми, като цис формата е обозначена с буквата Z (от немската дума zusammen), а трансформацията с буквата Е (entgegen). Понякога в имената на съединения, в които геометричната изомерия може да се появи многократно, заместителят с най-малък номер (според правилото за номериране) се обозначава с буквата g, а обозначенията c-(cis) и t-(trans) в отпред на други заместители посочете позицията им по отношение на г-н Зам.
Подобно на индол-3-илоцетната киселина (4.82), която стимулира растежа на растителните клетки, могат да действат и други карбоксилни киселини, чиято карбоксилна група е под ъгъл спрямо равнината на ароматния пръстен. Геометричният изомеризъм ограничава възможността за такова подреждане на два заместителя, следователно от канелените киселини е активен само цис-изомерът. В 2-фенилциклопропан-1-карбоксилна и 1,2,3,4-тетрахидронафталиден-оцетна киселина, само цис-изомерите също са активни. Молекулярните модели показват, че пръстенът и карбоксилната група в транс изомера (неактивни) на тези вещества лежат в една и съща равнина, докато в цис формата (активни) те не са копланарни. Veidstra беше първият, който посочи тази връзка между некомпланарността и дейността, насърчаваща растежа. Некомпланарността може да възникне и поради пространствено препятствие. По този начин бензоената киселина има плоска форма и не е активна, докато 2,6-дихлоробензоената и 8-метил-1-нафтоената киселина са неравнинни и биологично активни.
В ауксиновите аналози карбоксилната група може да бъде заменена с други електрон-оттеглящи групи (-CN, -N02, -SO3H), докато биологичната активност е само леко намалена. За връзката между структура и действие в тази поредица вижте Koepfli, Thimann, Went (1938) и Veidstra
Геометричната изомерия на стероидите заслужава специално внимание. Формула (12.29) показва общата структура на тази група естествени наситени съединения (показана е номерацията на въглеродните атоми и буквените обозначения на четирите цикъла). В естествените стероиди пръстените B и C са в транс-връзка, като и двата са закотвени в конформация на стол. При сърдечните гликозиди връзката на циклите C и D има цис конфигурация, но при животинските хормони, стеролите и жлъчните киселини тя е транс връзка. В повечето биологично активни стероиди, пръстените A и B са в транс-връзка (серия "5a", наричана преди това "allo"). Всеки от пръстените в стероидната молекула образува гънки, което се вижда ясно в страничната проекция на формула (12.30).
Означението "5а" показва, че водородният атом в позиция 5 е под общата равнина на пръстените. Всички заместители, разположени под тази равнина, са обозначени със символа "а", а отгоре - със символа, показан във формули (12.34) и (12.35).
ция на заместителите в пространството и формата на цикъла. Например циклохексанът може да съществува в три конформации: стол (12.36), вана (12.37) и усукан (или полу-стол) (12.38).
Формата на стола е най-малко стресирана и следователно най-предпочитана за молекулата на циклохексан, като всеки аксиален водороден атом е отстранен с 0,25 nm от другите два аксиални водородни атома, разположени от същата страна на цикъла. Усуканата (или туист) форма заема междинна позиция (между формите стол и лодка), а най-интензивна е формата на вана. Последният обаче може да бъде стабилизиран от два или повече кондензирани пръстена, съдържащи подходящи заместители. Молекулата декахидронафталин (декалин) може да съществува в две стабилни форми, чиято структура е определена чрез електронна дифракция, която показва, че транс формата (точка на топене -30 ° C, точка на кипене 117 ° C при 100 mm Hg) се състои от две транс-кондензирани пръстени в конформация стол, а цис формата (точка на топене -43 °C, точка на кипене 124 °C при 100 mmHg) се състои от два цис-кондензирани пръстена в конформация стол. Цис формата преминава в транс форма при повишени температури и в присъствието на катализатор. Молекулата на декалин е пример за геометрична изомерия по отношение на свързващите въглеродни атоми, но всеки цикъл остава конформационно подвижен.
Интерес представлява конформационният анализ на -CO-H- връзката, която определя структурата на пептидите. В протеините неговата конформация винаги е „разширена“ (транс), въпреки че в пептидите, съдържащи пролин, т.е. третична амидна група, делът на равновесната „затворена“ (цис) конформация е доста голям (до 40%). Във вторичните формамиди има равновесна смес от „удължени“ и „затворени“ конформери в съотношение 8:92 в случая на N-метилформамид (12.39, 12.40). Тяхното съществуване се установява от наличието на два отделни сигнала в PMR спектрите. С увеличаване на обема на заместителя при азотния атом делът на "разширения" конформер се увеличава, достигайки 18% при заместване на метиловата група с трет.-бутил.
Геометричните изомери са цис-транс изомерия или EZ изомерия. Техните действия разчитат на ограничено въртене на въглеродните двойни или единични връзки в цикличните съединения.В цикличните съединения въртенето между въглеродните единични връзки е ограничено и две различни групи са прикрепени към всяка въглеродна изомерия по подобен начин. Такива геометрични изомери често се различават по своите физични свойства. Това се дължи на формата на изомерите и общия диполен момент. Ако двата атома с най-висок приоритет останат от една и съща страна на изомера, тогава те се означават като Z, а ако са от противоположната страна, те се означават като E.
Кратка история на изомерията
Концепцията за конституционния изомеризъм е значителна стъпка напред в историята на съвременната химия и особено в развитието на органичната химия. До края на 1700 г. няколко чисти вещества са били изолирани чрез изследване на химията на „животните“ и „растенията“. Много са получени от Карл Вилхелм Шееле (1742-1786). Поради голямото разнообразие от органични съединения, всяко ново вещество представя различен елементен състав, който съответства на обобщено наблюдение от „минералната“ химия. Броят на изолираните органични съединения се увеличава в началото на 1800 г. чрез идентифицирането на различни вещества.
В своята книга за историята на химията Томас Томсън пише през 1830 г., че:
Берцелиус прилага теорията за атома и към растителното царство, като анализира няколко растителни киселини и показва своето атомно устройство, но тук възниква трудност, която при сегашното състояние на нашето знание не можем да преодолеем. Има две киселини, които се състоят от абсолютно еднакви атоми. Сега как трябва да отчетем тази поразителна разлика в свойствата? Несъмнено в различните начини, по които са разположени атомите във всяка от тях.
Тогава Томсън използва различните схеми на атомни символи, използвани по това време, за да обясни защо две киселини с еднакъв елементарен състав, класифицирани като геометрични изомери, имат различни физични и химични свойства.
До началото на 19 век се смяташе, че тези химикали, намиращи се в живите организми, притежават специална жизнена сила, свързана с живите същества, и че те са необходими на живите системи за възпроизвеждане. През 1828 г. Wöhler синтезира проба от урея, (NH2)2CO (също CH4N2O), която е неразличима от уреята, изолирана от биологична урина.
Той приготви това "животно" вещество от очевидно неорганичния (минералогичен) изходен материал амониев цианат, (NH4)NCO (също CH4N2O), който е резултат от комбинирането на амониев хлорид и сребърен цианат. Така бариерата между „живата“ и „неживата“ изомерия се срути.
В цис изомер две подобни групи остават от едната страна на двойната връзка, докато в транс изомер те остават от противоположната страна. Например 2-бутенът има два изомера цис и транс.
В цис изомер две метилови групи и две водородни групи остават от една и съща страна на двойната връзка, докато в транс изомер те остават от противоположната страна.
Когато една или повече групи, свързани с двойна връзка, не са еднакви, изомерите се наричат E или Z. За да уведоми този тип, потребителят ще трябва да предостави формулите на въглеводороди с геометрични изомери и да идентифицира атома с най-висок приоритет (най-висок атомен номер), прикрепен към всяка двойна връзка C. Ако двата атома с най-висок приоритет остават от една и съща страна на изомера, което се означава като Z, и ако са от противоположната страна, се означава като E.

Например 1-бромо-1-флуоропропан има два изомера. В Z-1 - бром - 1 - флуоропропан се вижда, че бромът има по-висок приоритет или по-висок атомен номер (35) от флуора (9), който е прикрепен към С-1. Въглеродът има по-висок атомен номер (6) от водорода (1), който е свързан към C-2 на това съединение. Тъй като въглеродните атоми с най-висок приоритет (от групата -CH3) и бромът, свързани с тези два въглеродни атома, са от една и съща страна, това съединение се определя като Z. От друга страна, в E-1 - бром - 1 - флуоропропан атоми с най-висок приоритет на С и брома са в противоположна посока, поради което се нарича Е-изомер.
Въглерод-въглерод двойна връзка
Изомерите са две молекули, които имат еднакъв атомен състав, но не са идентични. Атомите в двата изомера могат да бъдат свързани в различен ред (структурна изомерия) или могат да бъдат свързани по същия начин, но в различна ориентация - пространствена стереоизомерия.
Структурен и геометричен изомер в специални случаи - стереоизомер, трябва да отговаря на две изисквания:
- Има ограничено въртене в молекулата.
- И двата атома, включени в ограничителната връзка, имат две различни функционални групи, прикрепени към тях.
Често срещан пример за ограничено въртене е двойна връзка въглерод-въглерод. Тези връзки включват пи връзката; в повечето случаи не е полезно да се разкъсат.

Геометричните изомери имат структура, която влияе върху физичните свойства на съединението.
Цис/Транс система
Cis/Trans именуването е най-простата система за свързване. Първо се идентифицира най-дългата въглеродна верига в молекулата и след това се идентифицират интересуващите ни функционални групи. В цис изомера въпросните две групи са от една и съща страна на двойната връзка (цис означава "от една и съща страна" на латински). В транс изомера въпросните две групи са от противоположните страни на двойната връзка (транс означава напречно на латински). Например два различни геометрични изомера на бутен-2.

И двата атома с двойна връзка имат същите две групи като тези две групи, но се различават един от друг по един от двойните въглероди. Задачата става по-трудна, тъй като страничните вериги и функционалните групи стават по-сложни.
Официалната система за именуване на IUPAC използва обозначението E/Z. Няма специфична връзка между цис/транс и E/Z и двете системи не са взаимозаменяеми. Нотацията E/Z използва правилата за приоритет на Cahn-Ingold-Prelog и се счита за по-надеждна. Името на IUPAC за фумарова киселина е транс изомер с формула HO2CCH=CHCO2H, а малеиновата киселина е цис-бутендиова киселина.

IUPAC е Международният съюз за чиста и приложна химия, който определя международни правила и стандарти за етикетиране на химикали на всички езици.
В циклично съединение въртенето между въглеродните единични връзки е ограничено. По този начин изомерията също е възможна за този тип съединение, ако две различни групи са прикрепени към всеки въглерод. Има два изомера на 1,2-диметилциклопропан.

Единият е цис изомер, където две метилови групи са от едната страна, а другият е транс изомер, където две метилови групи са от другата страна.
Геометричните изомери се различават по своите физични свойства. Това се дължи на формата на изомерите и общия диполен момент. Например, те се различават по точката на кипене. Точките на кипене на цис и транс изомерите на 1,2-дихлоретилен са съответно 60,3 °C и 47,5 °C.
В цис изомера наличието на две диполни връзки (C-Cl) дава цялостен молекулен дипол. Това води до междумолекулни дипол-диполни сили. За тази сила цис изомерът има по-висока точка на кипене от транс изомера, където две диполни връзки (C-Cl) се анулират поради позицията им в противоположна посока.
Причината, поради която не е възможно да се завърти двойна връзка въглерод-въглерод, е, че има две връзки, свързващи въглеродните атоми заедно и пи връзката ще трябва да бъде прекъсната. Pi връзките се образуват чрез странично припокриване между p орбиталите. Ако някой се опита да завърти двойната връзка въглерод-въглерод, p-орбиталите вече няма да се подредят и следователно pi-връзката ще бъде прекъсната. Това струва енергия и се случва само ако връзката се нагрее много.
Много е лесно да се пропуснат важни елементи от геометричните изомери при конструиране на структурни формули при съкращаване. Например, много е изкушаващо да нарисувате бут-2-ен.Ако потребителят го изпише неправилно, съединението вече няма да бъде изомер. Ако има дори най-малък намек, че може да се използва изомер, винаги трябва да се използват съединения, съдържащи двойни връзки въглерод-въглерод, показващи правилни ъгли (120°) около въглеродните атоми в краищата на връзката. С други думи, трябва да използвате формата, показан на фигурата.

Съединенията, съдържащи двойна връзка въглерод-въглерод, имат ограничено въртене. За получаване на изомери трябва да бъдат изпълнени следните условия:
- ограничено въртене, обикновено включващо двойна връзка въглерод-въглерод;
- две различни групи в левия край на връзката и две различни групи в десния край.
Няма значение дали левите групи съвпадат с десните или не.
Геометричните изомери на алкените включват редица съединения, които се състоят от С и Н атоми във въглеродната верига. Тази група включва хомоложните серии с формула CnH2n. Най-простият алкен е етенът, който има два С атома и формула C2H4.

Структурната формула на етена е показана на фигурата по-горе. В по-дългите алкенови вериги допълнителните въглеродни атоми са прикрепени един към друг, използвайки само ковалентни връзки. Всеки въглероден атом също е свързан с достатъчно водородни атоми, за да образуват общо четири единични ковалентни връзки.
Във вериги с четири или повече С атома, двойната връзка може да бъде разположена в различни позиции, което води до образуването на структурни изомери. В допълнение към структурните изомери, алкените също образуват стереоизомери. Тъй като въртенето около множествена връзка е ограничено, групите, прикрепени към атоми с двойна връзка, винаги остават в същите относителни позиции.
Тези "блокирани" позиции позволяват на химиците да идентифицират различни изомери от заместители, за да определят кое вещество има геометрични изомери. Например, един структурен изомер C5H10 има следните стереоизомери.

Изомерът отляво, в който два заместителя (метилова и етилова група) са от една и съща страна на двойната връзка, се нарича цис изомер, докато изомерът отдясно, с два неводородни заместителя от противоположните страни, е транс изомер.
Например хлорът има приоритет, защото е по-тежък. От дясната страна бромът превъзхожда въглерода. Трето, определят се позициите на двата атома с по-висок ранг. Ако два атома са в цис позиция, подредбата е Z (от немски zusammen, което означава „заедно“). Ако атомите или групите са в транс позиция, подреждането е Е (от немското entgegen, което означава "противоположно").
Геометрични изомери Бутенът е алкен с твърда двойна връзка. Това означава, че всъщност има четири изомера, а не три, в позицията на двойната връзка. Има пети и шести въглеводород със същия състав, но те не са алкени, въпреки същата формула.

Образуването на пръстена на циклобутан или метилциклопропан заема пространството от два водородни атома, като двойна връзка, което ги кара да имат формули, идентични с различните бутени.
Примери за геометрични изомери:
- 1-бутилен (1-бутен);
- изо-бутилен (2-метил-пропен);
- цис-2-бутилен (цис-2-бутен);
- транс-2-бутилен (транс-2-бутен).
И бонуси: циклобутан и метилциклопропан, като и двата имат същата емпирична формула като изомерите на бутен, но не са алкени. Първото име е „често срещаното“ или „тривиалното“ име, а името в скоби е името на IUPAC.
Бутенът има много приложения - от гориво в коли до торби с хранителни стоки, носени ежедневно от стотици милиони хора по света. Химическата формула на бутен е C4H8, което означава, че се състои от четири С атома и осем Н атома, съединението е алкен.
Има няколко различни изомера или молекулни структури, които това съединение може да образува (IUPAC имена в скоби):
- алфа-бутилен (бут-1-ен);
- цис-бета-бутилен-((2Z)-бут-2-ен);
- транс-бета-бутилен - ((2Е)-бут-2-ен);
- изобутилен (2-метилпроп-1-ен).

Въпреки че всички те имат една и съща формула, техните структури се различават. Връзките между всеки от тези геометрични изомери са основно конституционни, което означава, че те имат една и съща молекулна формула, но различни връзки. Изключенията са цис-бета-бутилен и транс-бета-бутилен.
Много хора знаят, че трансмазнините са вредни за хората, а ненаситените са полезни за тях. Единствената разлика между тези две мазнини е, че едната има транс връзка, а другата има цис връзка, но тази лека диференциация може да направи значителна разлика във функцията на молекулата.
При цис-бета-бутилена и транс-бета-бутилена атомите са в същия ред, но полярностите са различни. Цис-изомерът е полярен, с двете CH3 групи от една и съща страна. Това го прави наистина обемист и сложен.Транс изомерът е неполярен, обемистите CH3 групи се редуват, давайки повече пространство в молекулата. Тази връзка се нарича цис-транс изомерия. Цис изомерите са полярни, докато транс изомерите не са.
Въпреки че всеки от тези изомери на бутен е съставен от едни и същи материали, всеки има различни физични свойства. Например точка на кипене:
- Цис-бета-бутилен: 3,7 °C.
- Транс-бета-бутилен: 0,8 °C.
- Изобутилен: -6,9 °C.
- Алфа-бутилен: -6,3 °C.
Материал за производство на пластмаса
Бутените са алкени с четири въглеродни атома, C4H8. Има няколко различни структурни или конфигурационни изомери на бутен, включително геометрични и оптични изомери. И четирите бутена имат подобни физични свойства, като са безцветни газове, тежки във вода и силно разтворими в етер и алкани. Разликите във физичните свойства се обясняват със структурата на молекулите. Например цис-бут-2-ен има по-висока точка на кипене от транс-бут-2-ен, защото е по-силен дипол.

Двете алкилови групи на цис-изомер действат с техния +I ефект в една и съща посока и по този начин се засилват, докато двете алкилови групи на транс-изомерите действат в противоположни посоки и по този начин се отслабват взаимно. Формулите на въглеводородите с геометрични изомери са посочени съгласно стандартите на IUPAC. Бут-1-ен има такава ниска точка на топене, защото CC единичната връзка между втория и третия въглероден атом е свободна да се върти и етиловата група може да се върти около оста на въртене във всички посоки.
Това затруднява класифицирането на молекулата в твърда кристална структура. Останалите три бутена с двойна връзка между 2-ри и 3-ти С атоми са много твърди и могат лесно да бъдат класифицирани в кристалната структура. Следователно те имат относително високи точки на топене. Тези аргументи не винаги са валидни, тъй като показаният пример е 2-метил-бут-2-ен (или изобутен). Двете метилови групи с техните +I ефекти действат в същата посока като цис-бут-2-ен и всъщност трябва да бъдат подобрени. Изобутенът обаче има много ниска точка на кипене от само -7 °C.
But-1-en и But-2-ene се използват за получаване на бутадиен и бутан-2-ол. Освен това алкените се използват като алкилиращи агенти. Така от изобутен и изобутан се получава важното гориво 2,2,4-Триметил-пентан, по-известен като изооктан. И накрая, бутените са изходни материали за производството на някои пластмаси, защото са лесни за полимеризация. Добре известна пластмаса на основата на But-1-en е полибутен-1, от който се правят тръбите.
Пентан, n-пентан, изопентан
Пентанът или n-пентанът е един от наситените алканови въглеводороди. Почти без мирис, n-пентанът е течен при условия на околната среда и е херакетитовият изомер на 3 изомера. Разклонените течни изоалкани C5 - C16 все повече се използват като гориво (Otto, Diesel). В допълнение, тези алкани присъстват в маслата за отопление и смазочните масла. Осигуряват пълно изгаряне. Преди да знаете характеристиките на такива съединения, трябва да посочите формулите на въглеводородите, имащи геометрични изомери:
- Агрегатно състояние - течност.
- Цвят - безцветен.
- Почти няма миризма.
- Лесно запалим.
- Парите могат да образуват експлозивни смеси, когато са изложени на въздух.
- Водоразтворимостта е много ниска (практически неразтворим).
- Много нестабилна връзка.
Най-важните източници на пентан са петролните масла, които варират значително по състав в зависимост от техния произход. Разделянето става чрез фракционна дестилация. Тук получавате следните фракции:
- Парафиново масло (точка на кипене > 320 °C).
- Петрол (точка на кипене 180 до 250 °C).
- Отопление / дизел (точка на кипене 250 до 320 °C).
- Суров бензин (точка на кипене до приблизително 180 °C).
- Нафтата съдържа разклонени въглеводороди (алкани) от C5 до C10.
- Изгаряне на пентан с кислород (стехиометрично).
- Крайните продукти са въглероден диоксид и вода. Формули на геометрични изомери: C5H12 + 8O2 ⟹ 5CO2 + 6H2O.
| Калоричност HU | Калоричност HU [kWh/kg] |
||
Геометричният изомер пентен-2 е универсален разтворител. Използва се за разпенване на фенолна смола и полистирен. Необходим е и като референтно вещество в газовата хроматография и като пропелент в спрей кутии.
Причината за възникването на геометрична изомерия е липсата на свободно въртене около σ връзката. Този тип изомерия е характерен за съединения, съдържащи двойна връзка и за алициклични съединения.
Геометричните изомери са вещества, които имат една и съща молекулна формула, една и съща последователност на свързване на атомите в молекулите, но се различават един от друг по различното разположение на атомите или атомните групи в пространството спрямо равнината на двойната връзка или равнината на пръстена.
Причината за възникването на този вид изомерия е невъзможността за свободно въртене около двойната връзка или σ-връзките, образуващи цикъла.
Например, бутен-2 CH 3 -CH=CH-CH 3 може да съществува под формата на два изомера, които се различават в местоположението на метиловите групи в пространството спрямо равнината на двойната връзка.
или 1,2-диметилциклопропан съществува под формата на два изомера, които се различават по разположението на метиловите групи в пространството спрямо равнината на пръстена:

За обозначаване на конфигурацията на геометричните изомери се използва цис-, транс-системата. Ако идентични заместители са разположени от една и съща страна на равнината на двойната връзка или пръстена, конфигурацията се означава цис-. ако на противоположни страни - транс-.
КОНФОРМАЦИОНЕН ИЗОМЕРИЗЪМ
Конформационната (ротационна) изомерия се причинява от въртенето на атоми или атомни групи около една или повече прости σ връзки. В резултат на въртене около C-C връзките, молекулите могат да имат различни пространствени форми, които се наричат конформации.
Например, една молекула етан, поради въртене около въглерод-въглеродна връзка, може да приеме безкраен брой конформации. всяка от които се характеризира с определена стойност на потенциалната енергия. Двете крайни конформации се наричат затъмнена и инхибирана.

В затъмнената конформация на етана, водородните атоми на метиловите групи, когато се гледат по дължината на връзката въглерод-въглерод, са разположени един зад друг. В инхибирано състояние водородните атоми на едната метилова група са максимално отдалечени от водородните атоми на другата. Между затъмнената и инхибираната конформации, молекулата приема много наклонени конформации по време на въртене.
Всяка конформация на молекулата на етана се характеризира с различна потенциална енергия. Затъмнената конформация има максимална енергия, а инхибираната конформация има минимална.
Инхибираната конформация, в която метиловите групи (обемистите заместители) са възможно най-отдалечени една от друга, се нарича анти-конформация. Другата инхибирана конформация се нарича гоша конформация.
Инхибираната гош конформация има малко по-висока потенциална енергия (поради взаимодействието метил-метил) от анти-конформацията (изобщо няма взаимодействие между метилите).
Конформациите с най-нисък енергиен резерв се наричат конформери или конформационни (ротационни) изомери.
Така n-бутанът при 25 °C съществува приблизително 70% под формата на антиконформер и 30% като гош конформер.
За разлика от конфигурационните изомери, конформерите се трансформират един в друг, без да разкъсват химичните връзки и не могат да бъдат разделени. Те се откриват само чрез физикохимични методи.
По време на урока ще получите обща представа за видовете изомерия и ще научите какво е изомер. Научете за видовете изомерия в органичната химия: структурна и пространствена (стереоизомерия). Използвайки структурните формули на веществата, разгледайте подтиповете структурна изомерия (скелетна и позиционна изомерия), научете за видовете пространствена изомерия: геометрична и оптична.
Тема: Въведение в органичната химия
Урок: Изомерия. Видове изомерия. Структурна изомерия, геометрична, оптична
Типовете формули, описващи органични вещества, които разгледахме по-рано, показват, че няколко различни структурни формули могат да съответстват на една молекулна формула.
Например молекулната формула C 2H 6Окореспондирам две веществас различни структурни формули - етилов алкохол и диметилов етер. Ориз. 1.
Етиловият алкохол, течност, която реагира с метален натрий за освобождаване на водород, кипи при +78,5 0 C. При същите условия диметиловият етер, газ, който не реагира с натрий, кипи при -23 0 C.
Тези вещества се различават по своята структура - различните вещества имат еднаква молекулна формула.
Ориз. 1. Междукласова изомерия
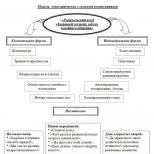
Феноменът на съществуването на вещества, които имат еднакъв състав, но различни структури и следователно различни свойства, се нарича изомерия (от гръцките думи "isos" - "равно" и "meros" - "част", "дял").
Видове изомерия
Има различни видове изомерия.
Структурната изомерия е свързана с различен ред на атомите в една молекула.
Етанолът и диметиловият етер са структурни изомери. Тъй като принадлежат към различни класове органични съединения, този тип структурна изомерия се нарича също междукласови . Ориз. 1.
Структурните изомери могат също да съществуват в рамките на един и същи клас съединения, например формулата C 5 H 12 съответства на три различни въглеводорода. Това изомерия на въглероден скелет. Ориз. 2.

Ориз. 2 Примери за вещества - структурни изомери
Има структурни изомери с еднакъв въглероден скелет, които се различават по позицията на множество връзки (двойни и тройни) или атоми, заместващи водорода. Този вид структурна изомерия се нарича позиционна изомерия.
Ориз. 3. Изомерия на структурно положение
В молекули, съдържащи само единични връзки, е възможно почти свободно въртене на молекулни фрагменти около връзките при стайна температура и, например, всички изображения на формулите на 1,2-дихлороетан са еквивалентни. Ориз. 4

Ориз. 4. Разположение на хлорните атоми около единична връзка
Ако въртенето е възпрепятствано, например, в циклична молекула или с двойна връзка, тогава геометрична или цис-транс изомерия.В цис-изомерите заместителите са разположени от едната страна на равнината на пръстена или двойната връзка, в транс-изомерите - от противоположните страни.
Цис-транс изомери съществуват, когато са свързани към въглероден атом. две различнидепутат Ориз. 5.



Ориз. 5. Цис и транс изомери
Друг вид изомерия възниква поради факта, че въглероден атом с четири единични връзки образува пространствена структура със своите заместители - тетраедър. Ако една молекула има поне един въглероден атом, свързан с четири различни заместителя, оптична изомерия. Такива молекули не съвпадат с огледалния си образ. Това свойство се нарича хиралност - от гръцки стук- "ръка". Ориз. 6. Оптичната изомерия е характерна за много молекули, които изграждат живите организми.
|
|
|
Ориз. 6. Примери за оптични изомери
Нарича се още оптична изомерия енантиомеризъм (от гръцки енантиос- „противоположно“ и meros- "част") и оптични изомери - енантиомери . Енантиомерите са оптично активни; те въртят равнината на поляризация на светлината под същия ъгъл, но в противоположни посоки: д- , или (+)-изомер, - вдясно, аз- , или (-)-изомер, - вляво. Смес от равни количества енантиомери т.нар рацемат, е оптически неактивен и се обозначава със символа d,l- или (±).
Обобщаване на урока
По време на урока получихте общо разбиране за видовете изомерия и какво е изомер. Запознахме се с видовете изомерия в органичната химия: структурна и пространствена (стереоизомерия). Използвайки структурните формули на веществата, разгледахме подвидовете на структурната изомерия (скелетна и позиционна изомерия) и се запознахме с видовете пространствена изомерия: геометрична и оптична.
Библиография
1. Рудзитис Г.Е. Химия. Основи на общата химия. 10. клас: учебник за общообразователни институции: основно ниво / Г. Е. Рудзитис, Ф. Г. Фелдман. - 14-то издание. - М.: Образование, 2012.
2. Химия. 10 клас. Ниво на профил: академичен. за общо образование институции/ В.В. Еремин, Н.Е. Кузменко, В.В. Лунин и др.. - М.: Дропла, 2008. - 463 с.
3. Химия. 11 клас. Ниво на профил: академичен. за общо образование институции/ В.В. Еремин, Н.Е. Кузменко, В.В. Лунин и др.- М .: Bustard, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задачи по химия за постъпващи във ВУЗ. - 4-то изд. - М.: РИА "Нова вълна": Издател Умеренков, 2012. - 278 с.
Домашна работа
1. № 1,2 (с.39) Рудзитис Г.Е. Химия. Основи на общата химия. 10. клас: учебник за общообразователни институции: основно ниво / Г. Е. Рудзитис, Ф. Г. Фелдман. - 14-то издание. - М.: Образование, 2012.
2. Защо броят на изомерите във въглеводородите от етиленовата серия е по-голям от този на наситените въглеводороди?
3. Кои въглеводороди имат пространствени изомери?